Libreta de apuntes
Enlaces relacionados
¿Qué es el glicol?
El glicol es un compuesto químico que pertenece al grupo de los dioles. Es un líquido transparente, incoloro, ligeramente espeso como el almíbar y leve sabor dulce. Por estas características organolépticas se suele utilizar distintos colorantes para reconocerlo y así disminuir las intoxicaciones por accidente. A temperatura ambiente es poco volátil, pero puede existir en el aire en forma de vapor. Se fabrica a partir de la hidratación del óxido de etileno (epóxido cancerígeno).
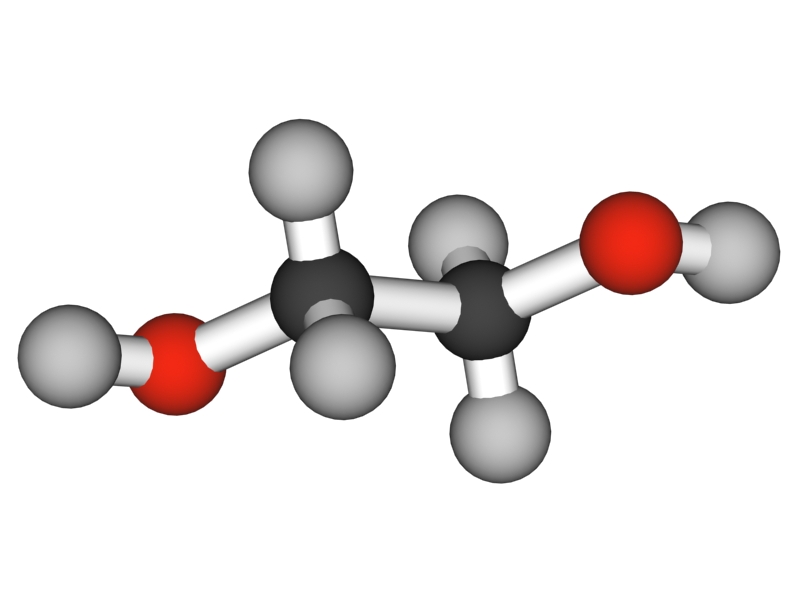
El glicol (HO-CH2CH2-OH) se denomina sistemáticamente etan-1,2-diol. Se trata del diol más sencillo, nombre que también se emplea para cualquier poliol. Su nombre deriva del griego glicos (dulce) y se refiere al sabor dulce de esta sustancia. Por esta propiedad ha sido utilizado en acciones fraudulentas intentando incrementar la dulzura del vino sin que el aditivo fuera reconocido por los análisis que buscaban azúcares añadidos. Sin embargo es tóxico y produce disfunción renal.
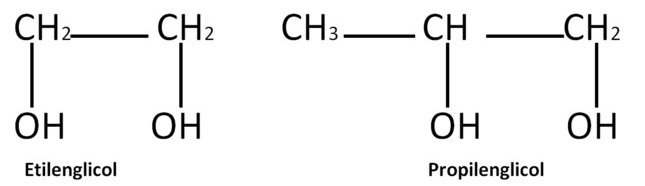
Tanto el glicol de etileno como el glicol de propileno son líquidos transparentes, incoloros, ligeramente espesos como almíbar a temperatura ambiente. Cualquiera de los dos compuestos puede existir en el aire en forma de vapor, aunque el glicol de propileno debe ser calentado o agitado vigorosamente para producir vapor. El glicol de etileno es inodoro pero tiene un sabor dulce. El glicol de propileno prácticamente no tiene olor ni sabor.
Propiedades
El glicol es una sustancia ligeramente viscosa, incolora e indolora con un elevado punto de ebullición y un punto de fusión de aproximadamente -12 °C (261 K). Se mezcla con agua en cualquier proporción.
En la industria del poliuretano flexible estos productos tienen una denominación general y son llamados "Poliol".
Aplicaciones
La Administración de Alimentos y Drogas (FDA, por sus siglas en inglés) ha clasificado al glicol de propileno como un aditivo "generalmente reconocido como inocuo" para uso en alimentos. Es usado para absorber el exceso de agua y mantener humedad en ciertos medicamentos, cosméticos o alimentos. Es un solvente para colores y condimentos de alimentos.
Se utiliza como anticongelante en los circuitos de refrigeración de motores de combustión interna, como difusor del calor,
El glicol de etileno es también un ingrediente en líquidos para revelar fotografías, fluidos para frenos hidráulicos y en tinturas usadas en almohadillas para estampar, bolígrafos, y talleres de impresa.
Se utiliza como aditivo en los radiadores de motores de combustión interna, ya que funciona como anticongelante y refrigerante justamente por sus dos propiedades. En los sistemas de refrigeración de los automóviles modernos el refrigerante (agua) funciona a presión, y puede alcanzar mas de 120 ° de temperatura.
Para fabricar compuestos de poliéster, y como disolvente en la industria de la pintura y el plástico. También en la síntesis de los poliuretanos, de algunos poliésteres, como producto de partida en la síntesis del dioxano, la síntesis del glicolmonometileter o del glicoldimetileter, como disolvente, etc.
El glicol de propileno es usado también para crear humo o neblina artificial usados en adiestramientos para combatir incendios y producciones teatrales
Precauciones
Comer o tomar cantidades sumamente altas de glicol de etileno puede causar la muerte, en tanto que cantidades grandes pueden producir náusea, convulsiones, dificultad para hablar, desorientación, y problemas al corazón y al riñón. Animales hembras que comieron grandes cantidades de glicol de etileno tuvieron crías con defectos de nacimiento, mientras que animales machos experimentaron una disminución en el número de espermatozoides. Sin embargo, estos efectos se observaron a niveles muy altos y no se espera que ocurran en gente expuesta a niveles menores en sitios de residuos peligrosos.
El glicol de etileno afecta la química del organismo aumentando la cantidad de ácido, lo que produce problemas metabólicos. Al igual que el glicol de etileno, el glicol de propileno también aumenta la cantidad de ácido en el organismo. Sin embargo, se necesitan cantidades de glicol de propileno mayores para producir este efecto.
La EPA ha establecido una norma para adultos de 7,000 microgramos por litro (7,000 µg/L) para glicol de etileno en agua potable.
Puede causar sordera, ceguera y puede dejar grandes secuelas cerebrales, y a grandes dosis producir la muerte.
Es un disolvente orgánico con actividad nefrotóxica como se mencionó anteriormente. Puede ocasionar necrosis tubular aguda que si no se trata a tiempo, puede desencadenar una insuficiencia renal crónica y posteriormente la muerte.
La FDA ha clasificado al glicol de propileno como "generalmente reconocido como inocuo," lo que significa que es aceptable para uso en condimentos, medicamentos, y cosméticos, y como aditivo directo en alimentos.
La Conferencia Americana de Sanitarios Industriales de Gobierno (ACGIH, por sus siglas en inglés) recomienda un nivel máximo de 127 miligramos de glicol de etileno por metro cúbico de aire (127 mg/m³) para una exposición de 15 minutos.
El glicol de propileno generalmente se considera como una sustancia inocua, que no es necesario analizar rutinariamente a menos que se puedan asociar síntomas específicos con exposición a sustancias tales como medicamentos o cosméticos.
Debido a que el glicol de propileno se degrada rápidamente en el cuerpo, es difícil de detectar aun cuando haya síntomas presentes.
Toxicidad
Absorción: se absorbe eficazmente a través del tracto digestivo. Su absorción respiratoria se ve dificultada por su acción irritante a ese nivel y su absorción dérmica es escasa.
Biotransformación: el etilenglicol es oxidado por las mismas enzimas que transforman el etanol y metanol (ADH (alcohol deshidrogenasa), MAOS(mono amino oxidasas) y catalasas), formándose ácido glicólico (acidosis metabólica) y ácido oxálico (metabolito final). El ácido oxálico tiene gran afinidad por el calcio produciendo a nivel periférico una acumulación perivascular de oxalato de calcio monohidratado, el cual posee forma de aguja, produciendo daño en estos órganos.
Clínicamente puede manifestarse por una disminución del nivel de consciencia (letargia), un estado comatoso (debido a la depresión del sistema nervioso central) e insuficiencia renal aguda; se encuentra asociado a un desorden ácido-base (específicamente por ácido glicólico) causando acidosis metabólica del tipo anión gap (brecha aniónica), y osmolar elevados, pero si no se trabaja de forma rápida la cantidad osmolar de intoxicación de etilenglicol será mucho menor, ya que el etilenglicol al ser metabolizado deja menor cantidad disponible en niveles séricos, disminuyendo esta medición y permitiendo dudar en el caso de pacientes que puedan haber sufrido este tipo de intoxicación. Hay una disminución de la leucocitosis y aparición de cristales de oxalato de calcio monohidratado. No se altera la concentración plasmática de sodio. Como fenómeno compensador al estado de acidosis metabólica se desencadena un cuadro de hiperventilación con excursiones respiratorias profundas (respiración de Kuss-Maul) disminuyendo la presión parcial de CO2 arterial y llevando a 99% de unión de oxígeno en hemoglobina.
Síntesis
El glicol se genera industrialmente a partir de etileno mediante oxidación con oxígeno en presencia de óxido de plata como catalizador e hidrólisis del óxido de etileno generado en la primera etapa.
Se produce a partir de etileno, mediante el compuesto intermedio óxido de etileno. El óxido de etileno reacciona con agua produciendo etilenglicol según la ecuación química: C2H4O + H2O --> HOCH2CH2OH
Esta reacción puede ser catalizada mediante ácidos o bases, o puede ocurrir en un pH neutro a temperaturas elevadas. La mayor producción de etilenglicol se consigue con un pH ácido o neutro en presencia de abundante agua. Bajo estas condiciones, se puede obtener una productividad del 90%. Los principales subproductos obtenidos son dietilenglicol, trietilenglicol, y tetraetilenglicol.
Documentación
http://www.atsdr.cdc.gov
http://blog.prefire.es
http://es.wikipedia.org/