Libreta de apuntes
Enlaces relacionados
- Ácidos orgánicos
- Ácidos grasos
- Albúmina
- Aminoácidos
- Aminoácidos esenciales
- Antioxidantes
- Biotina
- Carnitina
- Caseína
- Clara de huevo
- Colágeno
- Colesterol
- DOPAMINA
- Endorfinas
- Feniletilamina
- FIBRA DIETÉTICA
- Gelatina
- Glúcidos
- GLUCÓGENO
- Glucósidos
- Glutatión
- Gluten
- Hipercolesterolemia
- Lípidos
- Aditivos alimentarios
- Lipoproteínas
- Oligoelementos
- Ovoalbúmina
- Proteínas
- Quimilicrones
- Radicales libres
- Triptófano
ÍNDICE
- Introducción
- Propiedades
- Estructura química
- Biosíntesis del glutation
- Funciones del glutation
- GSH y estado redox
- GSH y cáncer
- GSH y ateroesclerosis
- GSH y malnutrición
- GSH y alcoholismo
- GSH y SIDA
- Glutatión humano
- Usos terapéuticos
- Usos dietéticas y suplementos alimenticios
- Patologías asociadas con el glutation
- Documentación
La página de Bedri
¿Qué es el glutation?
El glutatión, también conocido como GSH, es una es una proteína pequeña con una pequeña molécula formada por tres aminoácidos: cisteína, ácido glutámico y glicina, lo que se llama en química un tripéptido. Es un antioxidante, y protege a las células de toxinas tales como los radicales libres.
Hay infinidad de millones de veces más moléculas de glutatión en las células que unidades de vitamina E. El hígado contiene grandes cantidades de glutatión.
Propiedades
El glutatión (GSH) juega un papel fundamental en la protección celular contra la injuria oxidativa. Los cambios de la concentración de GSH en sangre podrían dar una medida del estrés oxidativo in vivo. El GSH disminuye con el envejecimiento, el ejercicio violento y también en ciertas patologías como diabetes, fibrosis quística, SIDA, cirrosis, infecciones, malnutrición proteica y tratamientos quimioterápicos, entre otros. El rol del GSH en diferentes funciones fisiológicas y en diversas patologías puede estudiarse empleando moléculas etiquetadas con isótopos estables, como por ejemplo con 13C. La cinética del 13CO2, generado a partir de un 13C-sustrato, constituye una herramienta útil en el estudio de rutas metabólicas. La 13C-oxatiazolidina carboxilato (OTC) permite evaluar el balance del glutatión en diferentes condiciones patológicas y fisiológicas, determinando el estado redox en cada situación. En este trabajo se discuten aspectos básicos del metabolismo del glutatión y su vinculación con determinadas patologías en el hombre; también se analiza la utilización de los isótopos estables como una herramienta no invasiva para evaluar el balance de glutatión en seres humanos.
Tener niveles adecuados de glutatión en el organismo nos ayuda a mantener un equilibrio óptimo en la eliminación de radicales libres (efecto antioxidante), así como auxiliar en la desintoxicación de las células del hígado debido a que ésta proteína tiene una excelente capacidad de reaccionar con sustancias tóxicas (acetaminofén, cobre, cadmio y paracetamol) y favorecer su eliminación. De esta manera el glutatión puede neutralizar los contaminantes medioambientales como el tabaco.
El glutatión es un componente clave para potenciar al máximo la actividad antioxidante de la vitamina C, vitamina E, NacetilLcisteina, ácido alphalipoico y el selenio. Junto con este último, tiene la función de regenerar la vitamina C gastada. Asimismo, el glutatión, el selenio y la vitamina C juntas regeneran la vitamina E.
Esta relación sinérgica mantiene las defensas antioxidantes de la célula intactas todo el tiempo. La presencia de niveles adecuados de glutatión junto a los otros antioxidantes en nuestros cuerpo es fundamental para tener un sistema defensivo efectivo contra los radicales libres.
Junto a los beneficios mencionados anteriormente (efectos antioxidantes y desintoxicantes), el glutatión proporciona ayuda en los siguientes procesos:
- Mantenimiento del sistema inmune. Particularmente importante para la activación de los linfocitos y plaquetas.
- Reduce la proliferación de células con tendencia a la malignidad, jugando un papel clave en la colaboración para la defensa de diferentes enfermedades causadas por la presencia de radicales libres, incluyendo cáncer, inflamación, Alzheimer, mal de Parkinson, fibrosis cística, SIDA, ataques cardiacos y diabetes.
- Ayuda, junto con los demás antioxidantes, a reforzar la resistencia al daño oxidativo, revirtiendo la capacidad de metástasis e incrementando la respuesta de las células a la quimioterapia.
- Por su acción antioxidante podría ayudar a disminuir los casos de ceguera ocasionada por cataratas, desarrolladas por el estrés oxidativo ocasionado por una alta concentración de oxigeno de las células del cristalino, debidas al bajo consumo de antioxidantes en la dieta.
Serios estudios científicos han detectado descensos del nivel de glutatión en todas las enfermedades crónicas y se ha comprobado su mejoría cuando se restablecen los niveles del mismo.
El glutatión es pues, un componente fundamental para la vida, si escasea en la célula existe la posibilidad de enfermar e incluso morir.
Sus funciones principales son: su actuación sobre el sistema inmunológico, la desintoxicación del organismo y la protección contra la radiación.
Los descensos de óxido nítrico provocados por los descensos de glutatión, se relacionan con el aumento de las inflamaciones y la génesis de muchas enfermedades crónicas.
Una de las principales acciones del glutatión, es que al descender el nivel de radicales libres se aumentan los niveles de óxido nítrico y se sabe que el descenso de óxido nítrico es la causa de innumerables patologías, principalmente la ateroesclerosis. Por otra parte, se regulan los niveles de homocisteína, los cuales suelen estar altos cuando se padece este problema, mejorando en la analítica la proteína C reactiva, la cual, junto con la homocisteína, se consideran los índices más seguros al seguir la evolución de dichos pacientes.
Asimismo, debe considerarse que buenos niveles de glutatión son fundamentales en la lucha contra el cáncer, hasta tal punto, que en oncología se utiliza la N-acetil cisteína, un derivado de la cisteína, en combinación con la quimioterapia para mejorar los resultados de la quimioterapia misma.
Investigadores americanos y europeos incluyendo R.M. Balansky, C.C. Conaway y A. Witschi han demostrado exitosamente que NAC inhibe los tipos de cáncer inducidos por toxinas como “urethane, noitrosamines, doxorubicin y ethylnitrosourea”
Una buena noticia es la capacidad de NAC de proteger contra las propiedades cancerígenas del cigarrillo. N. Van Sándwich del instituto de cáncer de Holanda escribe: “NAC ha surgido como un agente prometedor de quicio-prevención del cáncer”.
Un gran ensayo de quimio-prevención auspiciado por “Project Enroscan” midió el uso potencial de NAC contra cáncer de pulmón, de mama, estomacal y de la piel. Los resultados llevaron a comentarios favorables de S. De Flora, quien notó muchos mecanismos y efectos positivos de NAC y glutatión en la prevención del cáncer.
Hay que decir finalmente que se ha comprobado que los descensos de glutatión resultan en un descenso de la inmunidad, y que se vuelve a equilibrar de nuevo su nivel en el organismo cuando se restablecen los niveles de glutatión.
Existen pues cientos de investigaciones que avalan el uso del glutatión para prevenir y tratar enfermedades.
Estructura química
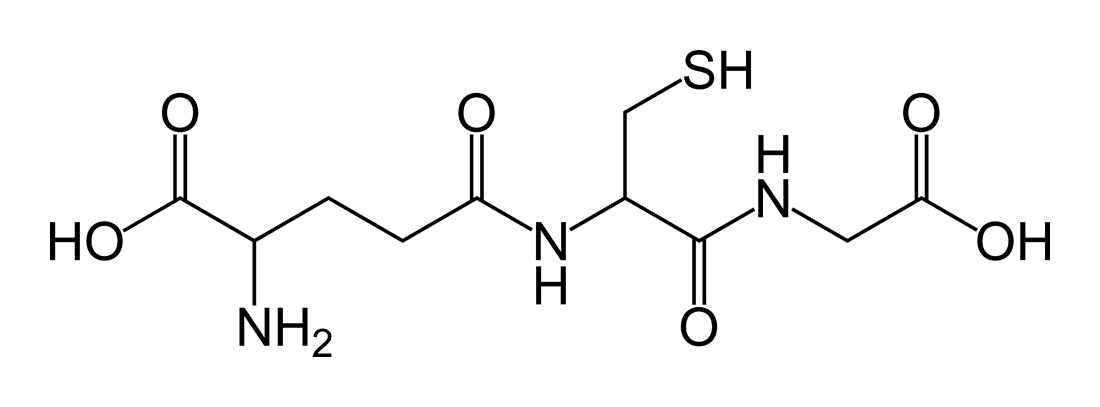
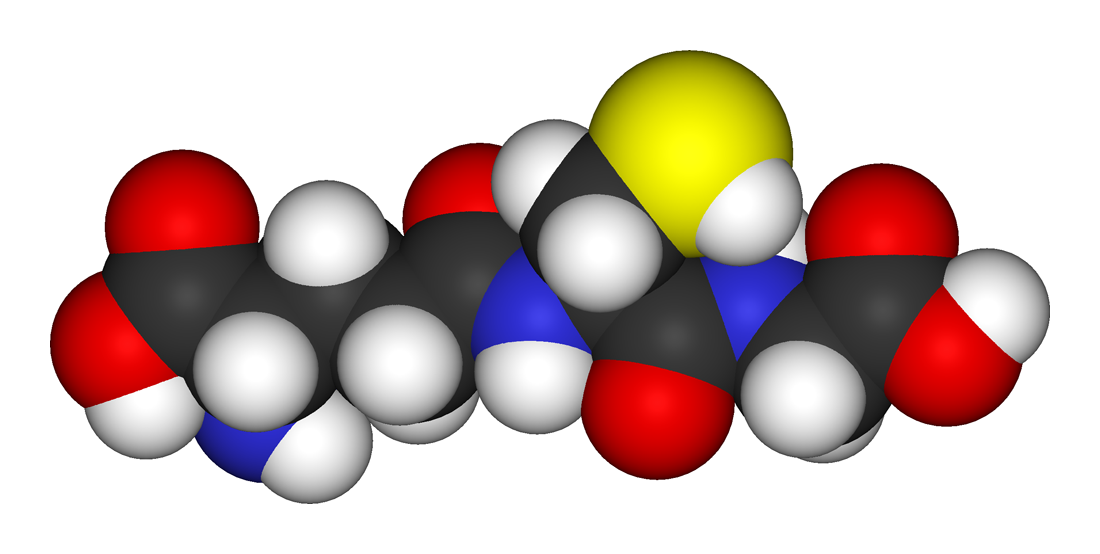
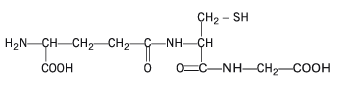
El glutation es un tripéptido constituido por tres aminoácidos: glicina, cisteína y ácido glutámico. Es 2-amino-5-{[2-[(carboximetil)amino]- 1-(mercaptometil)-2-oxoetil]amino}-5-ácido oxopentanoico, una γ-glutamilcisteinilglicina.
El glutatión (GSH) es un tripéptido que contiene un enlace peptídico inusual entre el grupo amino de la cisteína y el grupo carboxilo de la cadena lateral de glutamato. El glutatión tiene la habilidad de donar un electrón de hidrógeno, que hace posible su bioactividad. Por esta misma razón, se le ha llamado el antioxidante intracelular principal, es decir, el mejor antioxidante dentro de la célula.
Los grupos tiol se mantienen en un estado de reducción a una concentración de aproximadamente 5 mM en las células animales. El glutatión reduce a cisteínas cualquier enlace disulfuro formado dentro de las proteínas citoplasmáticas, actuando como un donante de electrones.
El glutatión es en realidad dos formas moleculares diferentes de la misma estructura básica, glutatión peroxidasa y glutatión disulfide. Packer confirma que el glutatión está presente en el cuerpo humano en dos formas, su forma reducida, lo cual es un potente antioxidante y su forma oxidada. El término glutatión es usado para referirse a todas estas diferentes estructuras del glutatión.
El glutatión se encuentra casi exclusivamente en su forma reducida, ya que la enzima que lo revierte a partir de su forma oxidada (GSSG), la glutatión reductasa, es constitutivamente activa e inducible bajo estrés oxidativo. De hecho, la proporción de glutatión reducido respecto a la de glutatión oxidado dentro de las células se utiliza a menudo científicamente como una medida de toxicidad celular.
Desde el punto de vista químico el glutatión (GSH) es el compuesto de bajo peso molecular con grupo sulfhidrilo (-SH) más importante en plantas y animales. Se trata de un tripéptido formado por los aminoácidos: ácido glutámico, glicina y cisteína (Glu-Gly-Cys).
El glutatión reducido se conoce químicamente como N-(N-L-gamma-glutamil-L-cisteinil) glicina, su fórmula molecular es C10H17N3O6S, su peso molecular 307.33 g/mol, su temperatura de fusión es 185-195ºC y su potencial redox 0,24 V. El glutatión oxidado es el L-gamma-glutamil-L-cisteinil-glicina disulfuro (GSSG), y su fórmula molecular es C20H32N6O12S2.
Es un antioxidante intracelular para lo cual usa el grupo tiol de la cisteína como agente reductor. Actúa reduciendo especies reactivas del oxígeno como peróxido de hidrógeno gracias a la enzima glutatión peroxidasa la cual cataliza la siguiente reacción:
H2O2 + 2GSH------- GSSG + 2 H2O.
El término glutatión es incorrecto. De acuerdo a las reglas de nomenclatura química: el sufijo inglés "-thione" corresponde al sufijo español "-tiona". En consecuencia, el término correcto es glutationa. Véase Vocabulario Científico y Técnico (3ª Edición, 1996) publicado por la Real Academia de Ciencias Exactas, Físicas y Naturales.
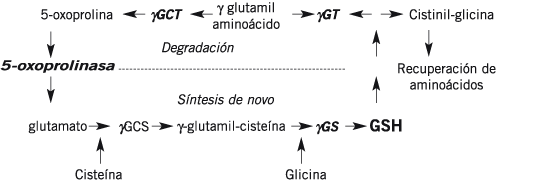
Biosíntesis del glutation
El glutatión no es un nutriente esencial, ya que puede ser sintetizado a partir de los aminoácidos L-cisteína, L-glutamato y glicina. Se sintetiza en dos pasos dependientes de ATP (adenosín trifosfato):
La síntesis ocurre en dos etapas y depende de la disponibilidad de sustratos y de los mecanismos regulatorios. El paso de regulación en la síntesis ocurre a nivel de la enzima gamma-glutamil cisteinil sintetasa (gGCS), donde el GSH ejerce el feed back negativo.
En primer lugar, se sintetiza gamma-glutamilcisteína a partir de L-glutamato y cisteína, mediante la enzima gamma-glutamilcisteína sintetasa (glutamato cisteína ligasa, GCL). Esta reacción es el paso limitante en la síntesis del glutatión.
En segundo lugar, la glicina se añade al terminal C de la gamma-glutamilcisteína mediante la enzima glutatión sintetasa.
La glutamato cisteína ligasa (GCL) es una enzima heterodimérica compuesta por una subunidad catalizadora (GCLC) y otra moduladora (GCLM). La GCLC lleva a cabo toda la actividad enzimática, mientras que la GCLM aumenta la eficiencia catalítica de la GCLC. Los ratones que carecen de GCLC (es decir, de la síntesis de novo de glutatión) mueren antes de nacer. Los ratones que carecen de GCLM no muestran ningún fenotipo exterior, sino una marcada disminución de GSH y una mayor sensibilidad a los tóxicos.
Aunque todas las células en el cuerpo humano son capaces de sintetizar glutatión, su síntesis en el hígado ha demostrado ser esencial. Tras el nacimiento, los ratones con pérdida de GCLC sólo en el hígado mueren tras un mes de vida.
La ruta biosintética del glutatión se encuentra en algunas bacterias, como las cianobacterias y las proteobacterias, pero falta en muchas otras bacterias. La mayoría de los eucariotas sintetizan glutatión, incluidos los seres humanos, aunque algunos no lo hacen, como las leguminosas, entamoebas y giardias. Las únicas arqueas que sintetizan glutatión son las halobacterias.
El GSH está sujeto a un constante recambio en el organismo; hígado, riñones, pulmones, corazón, intestinos y músculos son los principales órganos responsables de su homeostasis. La captación de cada órgano o tejido depende de la actividad de la enzima gamma glutamil transpeptidasa (g GT o GGT) localizada en la membrana celular.
Dentro de las células el GSH se encuentra principalmente en mitocondrias, retículo endoplásmico y núcleo y es aquí donde se observa un aumento de su concentración en la apoptosis o muerte celular programada.
Además de las mencionadas pueden existir otras vías metabólicas para el GSH; por ejemplo, para la eliminación de compuestos tóxicos generalmente se forman tioéteres con el GSH y se obtienen productos conjugados con el glutatión a través de una unión con azufre. El derivado azufrado luego pierde glutámico y glicina, y conserva la cisteína. Posteriormente, la acetilación de la cisteína origina los llamados compuestos mercaptoúricos que aparecen en orina. Este proceso explica porqué la cisteína es el aminoácido limitante para la síntesis del GSH, ya que a diferencia de lo que ocurre con los otros dos aminoácidos, no se recupera y su concentración intracelular es muy baja
Funciones del glutation
Producido en el cuerpo, el glutatión es el principal antioxidante agua-soluble en el citoplasma de la célula. Es extremadamente importante que sea constantemente producido por las células y es también puesto en reserva en la estructura molecular de la proteína.
El glutation protege al organismo frente a la oxidación y las toxinastoxinas. El glutatión se encuentra en las células de los organismos vivos y su principal función es la eliminación de los desechos la célula. En el cuerpo humano, desempeña tres funciones:
- Neutraliza los radicales libres. Al neutralizar los radicales libres de las células rojas de la sangre, éstos protegen a las células rojas contra daño.
- Se une a las toxinas del hígado para que puedan ser excretadas.
- Es también un cofactor o activador para muchas enzimas del cuerpo.
El glutatión existe en estado reducido (GSH) y oxidado (GSSG). En estado reducido, el grupo tiol de la cisteína es capaz de donar un equivalente de reducción (H+ + e-) a otras moléculas inestables, tales como las especies reactivas del oxígeno. En la donación de un electrón, el glutatión mismo llega a ser reactivo, pero reacciona fácilmente con otro glutatión reactivo para formar disulfuro de glutatión (GSSG). Esta reacción es posible gracias a la relativamente alta concentración de glutatión en las células (hasta 5 mm en el hígado). El glutatión puede ser regenerado a partir de GSSG mediante la enzima glutatión reductasa.
En las células y tejidos sanos, más del 90% del glutatión total está en la forma reducida (GSH) y menos del 10% en forma de disulfuro (GSSG). Un aumento de la proporción GSSG/GSH se considera una señal de estrés oxidativo.
El glutatión es un sustrato tanto en reacciones de conjugación como de reducción, catalizadas por enzimas glutatión S-transferasas en el citosol, los microsomas y las mitocondrias. Sin embargo, también es capaz de participar en la conjugación no enzimática con algunos productos químicos, como es el caso de la n-acetil-p-benzoquinona imina (NAPQI) y el citocromo reactivo P450 (metabolito formado mediante paracetamol), que pasan a ser tóxicos cuando el GSH se agota por una sobredosis de paracetamol. Esta capacidad del glutatión para unirse a la NAPQI puede usarse como un inhibidor del suicidio por paracetamol y en el proceso de desintoxicación, tomando el lugar de los grupos tiol de las proteínas celulares, que de otro modo serían modificados covalentemente; cuando todo el glutatión se ha gastado, la NAPQI comienza a reaccionar con las proteínas celulares, matando a las células en el proceso. El tratamiento preferido para una sobredosis de paracetamol es la administración (generalmente en forma atomizada) de N-acetil-L-cisteína, que es procesada por las células a L-cisteína y usada en la síntesis de novo de glutatión.
El glutatión participa en la síntesis de leucotrienos y es un cofactor para la enzima glutatión peroxidasa. También es importante como molécula hidrofílica que se añade a las toxinas y residuos lipofílicos en el hígado durante la biotransformación antes de que puedan pasar a formar parte de la bilis. El glutatión es necesario para la desintoxicación de metilglioxal, una toxina producida como subproducto del metabolismo. Esta reacción de desintoxicación se lleva a cabo mediante el sistema de la glioxalasa. La glioxalasa I (EC 4.4.1.5) cataliza la conversión de metilglioxal y glutatión reducido a SD-lactoil-glutatión. La glioxalasa II (EC 3.1.2.6) cataliza la hidrólisis de SD-lactoil-glutatión a glutatión y D-lactato.
GSH y estado redox
El estado redox en la célula indica el balance entre las especies oxidadas y las reducidas; está influido por factores fisiológicos, ambientales y nutricionales. De este balance dependen la activación de enzimas, la síntesis de ADN, la proliferación celular, los mecanismos de regulación de la apoptosis o muerte celular programada, el plegamiento de proteínas y la activación de factores de transcripción, entre otros. El GSH y el estado redox de algunos tioles (compuestos con grupo -SH) regulan la expresión de genes involucrados en la patogénesis de diferentes enfermedades (cáncer, ateroesclerosis, SIDA, diabetes, etc.)
Los principales reguladores del estado redox son el GSH, la cisteína, la tioredoxina (Trx) y las enzimas superóxidodismutasa (SOD) y glutatiónperoxidasa (GPX). A través de la medida de la concentración de especies antioxidantes, de la actividad de enzimas y de la relación de concentraciones de las formas oxidada y reducida del GSH (GSSG/GSH) se puede obtener un perfil de comportamiento redox para cada tejido. La determinación de la capacidad antioxidante total del plasma también puede ser útil para evaluar el estado redox, mientras que la relación en sangre GSH/GSSG reflejaría los cambios que se verifican en tejidos menos accesibles. Esta relación es mayor que 100 en condiciones normales; con el estrés oxidativo se acumula GSSG y una proporción alterada indica cambios en el estado redox que afectan el balance de la proliferación, la diferenciación y la muerte celular.
Los órganos para transplante se preservan refrigerados a 2 - 4 ºC para reducir los cambios o daños durante el período de espera. Se observó que el GSH jugaba un papel fundamental en el inicio de la apoptosis durante la preservación en frío de hepatocitos. Para evaluar su influencia se midieron, en cultivos sometidos a frío, los siguientes parámetros: ROS, GSH y GSSG, peroxidación lipídica y fragmentación de ADN. Durante el recalentamiento, la adición de N-acetil cisteína disminuyó significativamente el número de células con morfología apoptótica. También fue menor la producción de ROS, de peróxidos lipídicos y la depleción de GSH y de proteínas con grupos -SH.
Se comprobó que el GSH es responsable de la modulación, durante la preservación en frío y el recalentamiento, de la inducción apoptótica, del nivel de producción de radicales libres y de la peroxidación lipídica. Las células preapoptóticas y apoptóticas tienen menos GSH y proteínas con grupos -SH que las células normales, lo que evidencia la regulación redox del proceso.
La incubación con NAC, previa al recalentamiento del órgano, en el caso de transplantes hepáticos, tendría importancia terapéutica para prevenir los efectos tempranos de la apoptosis.
Otra situación en la que se manifiesta la regulación del GSH es en la glicosilación proteica (adición de glucosa a proteínas). Existe una relación inversa entre niveles de GSH y glicosilación. La hemoglobina glicosilada (HbG) revela el grado de glicosilación de otras proteínas también expuestas a la glucosa circulante y aumenta significativamente en la deficiencia de GSH de los eritrocitos expuestos a elevadas concentraciones de glucosa.
A continuación se comentará brevemente la vinculación existente entre los niveles de GSH y determinadas patologías.
GSH y cáncer
Las células cancerígenas pueden generar elevada cantidad de agua oxigenada (H2O2), la cual contribuiría en el daño y la mutación de tejidos, facilitando el crecimiento y la invasión del tumor. El estado persistente de estrés oxidativo explicaría parcialmente algunas características importantes del cáncer.
El aumento de GSH que puede aparecer en células tumorales se puede explicar como consecuencia de un aumento de la actividad mitótica. Los cambios de la velocidad de proliferación coinciden con cambios en la concentración intracelular de GSH. Cuando las células tumorales proliferan se producen más peróxidos, hay aumento de ROS y consecuentemente se oxida el GSH. Si disminuye la velocidad de proliferación, también lo hace el nivel de peróxidos.
El aumento de GSSG en sangre acompañando el crecimiento del tumor se puede atribuir a la oxidación de GSH en los eritrocitos y a un aumento de la liberación de GSSG desde diferentes tejidos. La anemia es un síntoma frecuentemente encontrado en los pacientes con cáncer; también se aprecian cambios enzimáticos que orientan hacia el estado oxidado.
Frente a casos de resistencia en la terapia contra el cáncer se considera de utilidad el conocimiento de la relación GSH/GSSG. Los ésteres del GSH son fármacos precursores del tripéptido que por sus características químicas pueden penetrar en las células y luego allí ser hidrolizados; así se logran elevados niveles de GSH que protegen a las células linfáticas contra los efectos letales de la radiación. La función más importante del GSH en la quimioterapia es su participación en la detoxificación de xenobióticos, peróxidos orgánicos y metales pesados; de este modo protege a las macromoléculas de las células, como por ejemplo el ADN.
GSH y ateroesclerosis
La oxidación de la lipoproteína de baja densidad, LDL, es el primer paso en el desarrollo de la ateroesclerosis. La citotoxicidad de la LDL oxidada también se manifiesta en la activación de los mecanismos apoptóticos. La LDL oxidada se comporta como pro-oxidante, aumenta los niveles de ROS y estimula la expresión de la enzima decisiva para la síntesis del GSH, así se protegerían las células contra el estrés oxidativo inducido por la LDL oxidada. El aumento de GSH depende del grado de oxidación de la LDL.
La enzima glutatiónperoxidasa (GPx) y el GSH protegen contra el stress oxidativo inducido por la LDL oxidada. En cultivos de células endoteliales se observó que el tratamiento previo con un agente que disminuye los depósitos celulares de GSH, el butilsulfóxido (BSO), provoca un aumento de la citotoxicidad provocada por LDL oxidada. La situación se revierte si se usan antioxidantes.
El sistema antioxidante, importante para prevenir el desarrollo de la ateroesclerosis, actuaría en diferentes niveles al prevenir la oxidación, disminuir la acción de la LDL oxidada y limitar la respuesta celular apoptótica a la lipoproteína oxidada.
GSH y malnutrición
El estudio de niños con malnutrición permitió determinar que tienen disminuido tanto el GSH como la velocidad de síntesis del mismo; presentan, además, una baja concentración de cisteína extra e intra celular y elevados niveles de marcadores de peroxidación lipídica inducida. El edema es una de las manifestaciones que se producen como consecuencia del severo daño a la membrana celular por acción de los radicales libres.
En los niños malnutridos también hay un menor aporte de cisteína a partir del metabolismo proteico; en el kwashiorkor, la velocidad de ruptura de las proteínas está disminuida por un déficit enzimático; pero no ocurre lo mismo en el marasmo. Las características del síndrome de kwashiorkor se asocian con el daño oxidativo debido al desbalance entre la generación de radicales libres y la capacidad antioxidante; se produce el daño oxidativo con las consecuentes subfunciones hepática e inmune.
En ensayos experimentales se observó que una dieta restringida en aminoácidos sulfurados disminuía la velocidad de síntesis de GSH y disminuía su recambio desde los tejidos. Una modificación en la disponibilidad dietaria de cisteína y de su precursor metionina puede modular la velocidad de síntesis de GSH y sus niveles en sangre, disminuyéndolos en el caso de la dieta sin aminoácidos azufrados.
Una situación así podría presentarse en los casos de la alimentación parenteral de pacientes que pasaron por una situación de stress. Puede suceder, por ejemplo, que después de una cirugía abdominal disminuya la capacidad de síntesis de GSH en los tejidos, pero que se mantenga el GSH de sangre; la diferencia dietaria estaría afectando entonces el recambio de GSH entre tejidos y sangre.
Los aminoácidos glicina o cisteína son igualmente adecuados para evaluar in vivo la velocidad de síntesis del GSH. En pacientes pediátricos internados con sepsis que recibían alimentación parenteral, se pudo determinar mediante el empleo de 13C-cisteína, que la velocidad de síntesis de GSH era muy inferior a la de los controles. Se observó que la suplementación con N-acetil cisteína llevó a un aumento significativo, en sólo 9 días de tratamiento, de la concentración de GSH, de cisteína y de la velocidad de síntesis del tripéptido. También se comprobó un efecto antiinflamatorio como consecuencia de la disminución de la concentración de interleuquinas en plasma.
Se pudo comprobar entonces que la terapia de suplementación con cisteína para restablecer el GSH durante las primeras etapas del tratamiento de la desnutrición disminuía la morbi-mortalidad infantil.
GSH y alcohólismo
El GSH se sintetiza en el citosol, pero entre 10 y 15% queda en las mitocondrias para protegerlas, principalmente, del agua oxigenada y de otros ROS que se producen en el metabolismo celular.
Mediante la exposición crónica de ratas a etanol se pudo observar un marcado decrecimiento del GSH mitocondrial (50%) debido a un deficiente transporte desde el citosol; también se vio alterada la microviscosidad interna de la mitocondria. Estas modificaciones determinan una susceptibilidad letal al stress oxidativo.
La metionina y su forma activa S-adenosil metionina son importantes en el metabolismo de fosfolípidos y en la estructura y función de la membrana mitocondrial. La administración de S-adenosil metionina previene los daños hepáticos inducidos por alcohol y protege a la mitocondria. La enzima vinculada en el proceso, metionina adenosil transferasa, es regulada por el estado redox a través de los niveles intracelulares de GSH y de la relación GSH/GSSG.
Por aumento del etanol aumenta la generación de ROS, disminuye la actividad de la metionina adenosil transferasa y disminuyen la S-adenosil metionina, y el GSH. Se genera un círculo vicioso que se puede interrumpir por la administración exógena de S-adenosil metionina.
GSH y SIDA
En la infección asintomática por HIV se desconocen los mecanismos por los que está alterada la homeostasis del GSH. El pool eritrocitario de GSH está disminuido, probablemente porque decae la velocidad de su síntesis y también porque hay una menor disponibilidad de cisteína.
Una persistente carga oxidativa conduce a un aumento del consumo de GSH que no se compensa con un incremento de la velocidad de síntesis del tripéptido. El hecho de que el nivel de GSH esté comprometido en individuos infectados con HIV y que esto juegue un rol muy importante en la patogénesis de la enfermedad está bien documentado aunque todavía se desconozcan los mecanismos responsables de la deficiencia de GSH. En los pacientes con esta patología existe un 40% menos del tripéptido en glóbulos rojos y plasma; también se encuentra disminuido en las células CD8 y CD4T y en el fluido epitelial de pulmón.
Es importante la instalación de un tratamiento con N-acetil cisteína o procisteína a fin de revertir parcialmente la situación, dado que el GSH es esencial para regular la proliferación celular, mantener la función de los eritrocitos, restringir la replicación del HIV y sobre todo para aumentar la sobrevida de los pacientes infectados. Mediante la administración de la N-acetil cisteína se logra restablecer y sostener la homeostasis del GSH (35-37). En la Tabla V se resumen las enfermedades antes mencionadas, y su relación con el GSH.
Glutatión humano
No hay requerimento dietético para el glutatión. El cuerpo lo produce a partir de cero, utilizando vitaminas y aminoácidos comunes que se encuentran en los alimentos.
Factores que consumen glutatión:
- El proceso de envejecimiento.
- Enfermedades crónicas como el cáncer y artritis.
- Aceites rancios.
- Drogas que estresan el hígado, como acetaminofén, aspirina, píldoras anticonceptivas, píldoras para reemplazar hormonas y muchos otros fármacos.
- Niveles inadecuados de los cimientos del glutatión, esto es, cisteína. Una buena fuente dietética de cisteína son los huevos, sandía, cebollas, ajo, yogurt y germen de trigo.
- Humo de tabaco y otros contaminantes ambientales.
- Otros alimentos procesados químicamente como carnes frías conteniendo nitratos
- Exceso del alcohol.
El glutatión está en constante demanda para combatir el estrés celular. Es difícil para la célula mantenerse al corriente con la interminable demanda de glutatión. Si los niveles de glutatión son inadecuados, los radicales libres van a incrementarse y se causará daño celular. El hecho de que el glutatión es uno de los más importantes de todos los antioxidantes está confirmado por el hecho de que este antioxidante es una de las substancias más abundantes en el cuerpo humano.
Los estudios del glutatión se han atrasado porque cuando éste es administrado oralmente, se descompone e inactiva por la digestión. Pero no todo está perdido! Ahora sabemos que si los cimientos del glutatión son establecidos, podemos mantener apropiados niveles de glutatión.
El Dr. Packer hizo un importante progreso en su laboratorio de Berkley cuando descubrió que el ácido lipoico, un antioxidante recientemente descubierto (llamado el antioxidante universal), estimuló un aumento del 30 por ciento en niveles del glutatión en el cuerpo. El Dr. Packer recomienda que tomemos ácido lipoico cada día para mantener un apropiado nivel de glutatión.
Ahora es conocido que el glutatión puede retardar el envejecimiento, así como elevar el sistema inmunológico. De acuerdo con el Dr. Packer, el glutatión no es solamente un poderoso antioxidante, es también esencial para preparar la síntesis del ADN para la multiplicación celular. Si el ADN resulta dañado, hay enzimas que necesitan ser activadas para repararlo, y esta es una de las muchas funciones del glutatión. Más adelante discutiremos acerca del ácido lipoico, el antioxidante universal.
Usos terapéuticos
Hay diversas investigaciones que apoyan la función de los antioxidantes como el glutatión en el mantenimiento de una buena salud y la prevención de enfermedades. El glutatión en su forma reducida es el principal antioxidante de las células, y protege de los radicales libres (los derivados activos del oxígeno). Esa reducción es posible gracias a la glucosa-6-fosfato deshidrogenasa, una enzima de la ruta de las pentosas fosfato. De hecho, una deficiencia de esta enzima puede tener efectos similares a la deficiencia de glutatión en términos de protección contra los radicales libres. El glutatión protege a las células de varios contaminantes y venenos, entre ellos algunos procedentes de la combustión y el humo de los cigarrillos. También retrasa el daño causado por la radiación.
- Envejecimiento: Se sabe que el envejecimiento va acompañado de una precipitada caída de nuestros niveles de glutatión. Estos niveles bajos también se encuentran a menudo en varias enfermedades asociadas con el envejecimiento, tales como cataratas, enfermedad de Alzheimer, enfermedad de Parkinson, arterioesclerosis y otras.
- Problemas neurológicos: los bajos niveles de glutatión se asocian con algunos trastornos neurodegenerativos, como la esclerosis múltiple, la enfermedad de Lou Gehrig, Alzheimer, Parkinson y otros.
- Cáncer: El glutatión juega un papel importante en la eliminación de diversos cancerígenos, manteniendo al mismo tiempo la optimización de funciones inmunitarias que hacen más eficaces las defensas anti-tumorales.
- Enfermedades del corazón y derrames cerebrales, colesterol: El aumento de los niveles de glutatión combate la oxidación de los ácidos grasos presentes en el torrente sanguíneo, incluyendo el colesterol, lo que retrasa el proceso de formación de placas en las arterias, que es la causa subyacente de la mayoría de los problemas de corazón.
- Diabetes: Los diabéticos son más propensos a las infecciones y problemas circulatorios, daño renal y ceguera. El glutatión protege de estas complicaciones relacionadas con la diabetes.
- Enfermedades pulmonares: Los médicos están utilizando medicamentos precursores de glutatión en diversas enfermedades pulmonares, como el asma, la bronquitis crónica y el enfisema. Destacan las nuevas propiedades terapéuticas para proteger de los daños causados por el humo del cigarrillo, la fibrosis pulmonar y otras enfermedades.
- Problemas digestivos: El glutatión protege contra la inflamación en los casos de gastritis, úlcera gástrica, pancreatitis, inflamación intestinal, úlcera de colon y enfermedad de Crohn.
- Hepatitis: El hígado es el órgano principal de almacenamiento de glutatión. Hay deficiencia de glutatión en la hepatitis alcohólica, así como en casos de hepatitis viral, entre ellos la hepatitis A, B y C. La elevación de los niveles de glutatión restablece las funciones del hígado.
- Problemas renales: Las personas que tienen daño renal o se someten a diálisis tienen altos niveles de oxidación, debido al estrés y la disminución de los niveles de glutatión. Elevar el glutatión ayuda a prevenir la anemia.
- Embarazo, parto, lactancia materna: El papel del glutatión en el desarrollo del feto y la placenta es crucial. Actúa en la placenta con el fin de neutralizar los contaminantes antes de que lleguen al niño en desarrollo. Se han relacionado varias complicaciones durante el embarazo con los bajos niveles de glutation.
Usos dietéticos y suplementos alimenticios
Convertir el glutatión en un suplemento alimenticio ha sido difícil, ya que la investigación sugiere que al ser ingerido por vía oral no se absorbe bien a través del tracto gastrointestinal. Sin embargo, las concentraciones de glutatión en el suero sanguíneo y los tejidos pueden aumentar ingiriendo precursores de la cisteína. Entre los precursores de glutatión ricos en cisteína están la N-acetilcisteína (NAC), y la proteína de suero de leche desnaturalizada. Estos suplementos han demostrado aumentar el contenido de glutatión dentro de la célula. La N-acetilcisteína es un suplemento disponible de forma genérica que aumenta el glutatión intracelular reducido y total en un 92% y un 58% respectivamente. Una proteína de suero de leche llamada Immunocal aumenta los niveles de glutatión en los linfocitos del sistema inmunitario en un 35,5%, y también aumenta el pico de potencia y el rendimiento muscular en un 13%.
Los efectos que se pueden esperar de un suplemento de glutation son:
- Prevención de las cataratas
- Prevención del decaimiento de la retina
- Prevención del cáncer, según las investigaciones citadas anteriormente
- Posible disminución del crecimiento de tumores
- Desintoxicación del hígado, las células y el sistema linfático
- Ayuda en la eliminación de las flemas de los pulmones
- Prevención de las enfermedades cardíacas
- Prevención de la artritis
- Prevención de la diabetes
- Estabilización del nivel de azúcar en la sangre
- Protección del sistema digestivo
- Estimulación del sistema inmunológico
- Ralentización del proceso de envejecimiento
- Optimización de los resultados atléticos
- Reducción de los daños al cerebro causados por una embolia
- Reducción de los daños al corazón causados por una crisis cardíaca
- Disminución de los niveles de colesterol
- Prevención de los glóbulos rojos.
Patologías asociadas con el glutation
El exceso de glutamato en la sinapsis, que puede ser liberado en condiciones tales como lesión cerebral traumática, puede impedir la absorción de cisteína, necesaria para la construcción de glutatión. Sin la protección contra el daño oxidativo que ofrece el glutatión, las células pueden ser dañadas o morir.
Documentación
http://www.coenzima.com
http://healthlibrary.epnet.com
http://www.<>
http://www.naturalbalancecore.com
http://www.scielo.org.ar
http://spanish.synergyworldwide.com
Mindell E, Hopkins, VL, "What You Should Know About the
Super Antioxidant Miracle," 1996. ("Lo que Debería Saber Acerca del
Super Antioxidante Milagro" Book Margins Inc. and Keats Publishing
Inc., New Canaan, CT.
Packer L, Colman C, The Antioxidant Miracle, 1999. John Wiley & Sons
Inc., NY.
Halliwell, B, Gutteridge, JMC, Free Radicals in Biology and Medicine,
2nd Edition, 1989. Oxford University Press, Oxford, UK
http://es.wikipedia.org/