Libreta de apuntes
Enlaces relacionados
- Ácidos orgánicos
- Aditivos alimentarios
- Alcaloides
- Alelopatía
- Almendra
- Aminoácidos
- Aminoácidos esenciales
- Antioxidantes
- Cafeína
- Capsaicina
- Carotenoides
- Catequinas
- Cumarinas
- Disacaridos
- Diterpenos
- Ester
- Esteroides
- FENILETILAMINA
- Fenol
- Fenoles
- Fitoalexinas
- Fitoesteroles
- Flavonoides
- Hidratos de carbono
- Glucosa
- GUARANINA
- Inulinas
- Irioides y sesquiterpenos
- Isoflavonas
- Lípidos
- Lipoproteínas
- MATEÍNA
- Monosacáridos
- Oligoelementos
- Oligosacáridos
- Polifenoles
- Polisacáridos
- Prostaglandinas
- Proteínas
- Quinina
- Quinonas
- Radicales libres
- RESVERATROL
- Saponinas
- Taninos
- TEÍNA
- Teobromina
- Teofilina
- Terpenos
- TIMOL
- Triglicéridos
- Triperpenos y esteroides
- Vitaminas
ÍNDICE
La página de Bedri
¿Qué son los fenoles?
Los fenoles son alcoholes aromáticos. Están compuestos de moléculas que tienen un grupo -OH unido a un átomo de carbono de un anillo bencénico. La estructura que se encuentra en todos los fenoles es el fenol. Todos los demás fenoles difieren con respecto a los grupos que están unidos al anillo aromático. Su fórmula general es Ar – OH, donde Ar significa radical bencénico o grupo aromático. Son compuestos diferentes a los alcoholes, a pesar que ambos poseen el grupo funcional hidroxilo.
Los fenoles presentan algunas características comunes con los alcoholes pero se diferencian en otras muchas por eso son tratados como una clase aparte. Cuando dos hidrógenos del anillo del benceno se sustituyen por grupos hidroxilos, se dice que son dihídricos, y en general reciben nombres comunes
Los fenoles además pueden tener varios anillos bencénicos (policíclicos) en la estructura molecular y acoplarse de diversa manera con diferentes radicales en los vértices de los hexágonos del anillo para formar compuestos de elevada complejidad y características muy diferentes.
Los fenoles en las plantas
Los compuestos fenólicos de las plantas son un grupo heterogéneo de productos con más de 10.000 compuestos. Algunos son solubles en solventes orgánicos, otros son glucósidos o ácidos carboxílicos y por lo tanto solubles en agua, y otros son polímeros muy grandes e insolubles.
Dentro del grupo de los fenoles estarán los ácidos fenólicos (p.e. ácido elágico) y la amplia familia de los flavonoides, entre otros. Los compuestos más simples son unidades individuales de fenol que se encuentran de forma abundante en las hierbas culinarias, se incluyen el apiol (que se encuentra en eneldo y perejil) y el carvracol (orégano). Todos ellos tienen una larga historia de utilización como conservantes de los alimentos.
Muchos son clasificados como metabolitos secundarios de las plantas, aquellos productos biosintetizados en las plantas que poseen la característica biológica de ser productos secundarios de su metabolismo. En general son sintetizados por una de dos vías biosintéticas: la vía del ácido shikímico o la vía del ácido malónico o por las dos; por ejemplo los flavonoides.
Las coloraciones azul, azulgrana y violeta que se observan en las bayas, uvas y berenjena púrpura se deben a su contenido fenólico. Los arándanos, por ejemplo, tienen una concentración elevada de antocianidinas fenólicas y son de color rojo. Los fenoles protegen a las plantas del daño por oxidación y realizan la misma función en los humanos.
Este grupo también juega una variedad muy heterogénea de roles en las plantas, roles que son atribuidos en general a los productos secundarios de las plantas: muchos son productos de defensa ante herbívoros y patógenos, otros proveen soporte mecánico a la planta, otros atraen polinizadores o dispersores de frutos, algunos de ellos absorben la radiación ultravioleta, o actúan como agentes alelopáticos; por ejemplo reducen el crecimiento de plantas competidoras que estén cerca.
Nomenclatura
El fenol, C6H5-OH , es el nombre dado al alcohol aromático más sencillo. La mayoría de los demás fenoles se nombran como derivados del fenol. Considere los nombres de los siguientes fenoles: p-bromofenol, o-nitrofenol, m-etilfenol.
Algunos fenoles disustituidos tienen nombres comunes que se utilizan frecuentemente. Cuando hay un grupo metilo unido a un anillo fenólico, el nombre del compuesto es cresol. Los tres cresoles isoméricos son: o-cresol, m-cresol y p-cresol.
Se utilizan tres nombres comunes para describir los compuestos que tienen dos grupos -OH unidos al anillo bencénico; éstos son: catecol, resorcinol, hidroquinona.
En el catecol, los grupos -OH están en posición orto entre sí. En el resorcinol y en la hidroquinona los grupos -OH están en posición meta y para, respectivamente.
Propiedades físicas
| Propiedades de los fenoles | |||
| Nombre | Pf | Pe |
solubilidad g/100 g H2O |
| fenol | 43 | 181 | 9.3 |
| o-cresol (o-metilfenol) | 30 | 191 | 2.5 |
| m-cresol (m-metilfenol) | 11 | 201 | 2.5 |
| p-cresol (p-metilfenol) | 36 | 201 | 2.3 |
| catecol (o-dihidroxibenceno) | 105 | 245 | 45 |
| resorcinol (m-dihidroxibenceno) | 110 | 281 | 123 |
| hidroquinona (p-dihidroxibenceno) | 170 | 286 | 8 |
|
Pf: punto de fusión en ºC. Pe: punto de ebullición en ºC. |
|||
Los fenoles presentan algunas propiedades semejantes a los alcoholes, debido a la presencia del grupo –OH. Sin embargo conforman otra familia química y la mayoría de sus propiedades y los métodos para su obtención son diferentes.
Los fenoles más sencillos son líquidos o sólidos blandos e incoloros y se oxidan con facilidad por lo que se encuentran coloreados. En presencia de impurezas o bajo influencia de la luz, el aire y ciertos compuestos como el cobre y el hierro, el fenol puede teñirse de amarillo, marrón o rojo
Los fenoles pueden formar puentes de hidrógeno debido a que contienen grupos -OH. Puesto que la mayoría de los fenoles forman enlaces fuertes de hidrógeno están en el estado sólido a temperatura ambiente. El fenol tiene un punto de fusión de 43°C y un punto de ebullición de 181°C. La adición de un segundo grupo -OH al anillo, como en el caso de resorcinol, aumenta la fuerza de los enlaces de hidrógeno entre las moléculas; en consecuencia, el punto de fusión (110°C) y el punto de ebullición (281°C) del resorcinol son significativamente mayores que los del fenol.
Solubilidad
El fenol es poco soluble en agua ya que aunque presentan el puente de hidrógeno, la proporción de carbonos con respecto a la cantidad de –OH es muy baja.
Para que los compuestos que contienen grupos –OH sean solubles en agua la razón entre carbonos y grupos –OH no debe ser mayor de 3:1. El fenol es el miembro más pequeño de este grupo y contiene 6 átomos de carbono y sólo uno de -OH.
Los demás monofenoles poseen mayor número de carbonos y sólo un grupo OH, por ello son insolubles en agua. Los difenoles y polifenoles con más de un grupo –OH presentan mayor solubilidad en el agua.
Punto de Ebullición
En general presentan altos puntos de ebullición debido a la presencia del puente de hidrógeno.
Punto de Fusión
Son altos comparados con los de los alcoholes, esto se debe a que están unidos por fuerzas intermoleculares más fáciles de vencer.
La formación de puentes de hidrógeno en los fenoles también explica su solubilidad en agua. La solubilidad del fenol puro es de 9.3 g/100 g de H2O. Recordemos que el benceno no polar, C6H6, es inmiscible en agua.
Propiedades químicas
La débil acidez del grupo fenólico ha determinado que se los agrupe químicamente junto a los ácidos carboxílicos y a los taninos, conformando así el grupo de los ácidos orgánicos.
Las propiedades de los fenoles están influenciadas por sus estructuras, en la reacción que se presenta a la derecha de este texto el fenol cede un protón al agua para formar el ión hidronio, de acuerdo a esto, el fenol se comporta como un ácido.
Los fenoles pueden en general, reaccionar de dos maneras diferentes, en una, los cambios químicos se producen en el grupo hidroxilo y en la otra en el propio anillo bencénico.
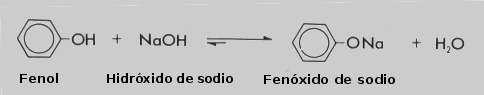
Los fenoles tienen a diferencia de los alcoholes, un carácter mas ácido y pueden reaccionar con el hidróxido de sodio para formar una sal, el fenóxido de sodio. En este caso el ion sodio sustituye al hidrógeno del grupo hidroxilo.
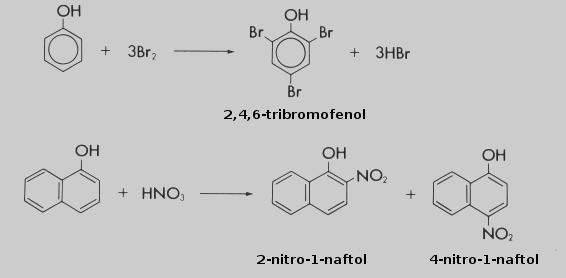
Cuando el fenol reacciona con el bromo (halogenación) se forma un tribromofenol, en el cual se acoplan tres átomos de bromo en los vértices del anillo bencénico quedando el grupo hidroxilo intacto.
La reacción de una molécula di-bencénica con el ácido nítrico (nitración) produce dos compuestos diferentes con el grupo NO2. Aquí tampoco el grupo hidroxilo participa.
Constantes de acidez
Si se comparan las constantes de acidez de los fenoles con las del agua, los alcoholes y los ácidos carboxílicos, se puede concluir que los fenoles son ácidos más fuertes que el agua y que los alcoholes, pero más débiles que los ácidos carboxílicos.
El fenol presenta cinco estructuras contribuyentes, es decir que pueden ceder protones. Dos de estas estructuras corresponden a la resonancia del anillo bencénico. La resonancia viene dada por la ubicación de los dobles enlaces dentro de la molécula.
Las otras tres estructuras son posibles debido al carácter básico del oxígeno que le permiten compartir más de un par de electrones con el anillo.
Síntesis del Fenol
Existen varios métodos para obtener compuestos fenólicos, entre ellos se cuentan la hidrólisis del clorobenceno, obtención a partir del benceno-sulfonato de sodio y la oxidación del isopropil-benceno.
Hidrólisis del clorobenceno
Para obtener el fenol, el clorobenceno se trata con una solución de hidróxido de sodio a ebullición y alta presión para obtener fenóxido de sodio. El fenóxido de sodio es una sal que reacciona con el ácido clorhídrico para formar fenol.
Producción de fenol a partir de benceno-sulfonato de sodio: para esto se hace reaccionar benceno con ácido sulfúrico fumante obteniendo ácido benceno-sulfónico, que tratado con cloruro de sodio o hidróxido de sodio produce una sal denominada bencenosulfonato de sodio. El bencenosulfonato de sodio se funde con hidróxido de sodio para obtener fenóxido de sodio que tratado con ácido sulfúrico libera fenol.
Oxidación del isopropil benceno
El isopropil benceno se oxida en presencia del oxígeno del aire permitiendo obtener hidroxiperóxido de cumeno, que al tratarse con ácido fuerte en agua se convierte en fenol y propanona.
A partir del fenol es posible producir otros compuestos químicos, su carácter ácido le permite ceder un protón para formar así sales y éteres.
Otras reacciones como la esterificación, la halogenqación, la nitratación, la sulfonación permiten obtener productos químicos como ésteres, halógenos, productos nitrogenados y ácidos sulfónicos entre otros.
Clasificación
En base a su esqueleto químico:
Fenoles simples:
Fenilpropanoides simples: que tienen
un esqueleto básico de fenilpropanoide (un anillo aromático unido a una
cadena de 3 carbonos). Ejemplos: ácido trans-cinámico, ácido p-cumárico,
y sus derivados como el ácido cafeico.
Lactonas fenilpropanoides (o "ésteres cíclicos"), también
llamadas cumarinas. También
poseen un esqueleto fenilpropanoide pero el propano está ciclado.
Ejemplos: la umbeliferona (una cumarina simple), el "psolaren" (una
furanocumarina:
cumarina a la que se adicionó un anillo furano).
Derivados del ácido benzoico (el esqueleto es un anillo aromático
unido a un carbono). Son formados a partir de fenilpropanoides a los que
se les delecionan dos carbonos de la cadena propánica. Ejemplos: la
vainillina, el ácido salicílico.
Fenoles complejos:
Lignanos.
Flavonoides.
Procedencia
En el grupo de los fenoles, los cresoles y el compuesto base mismo son los compuestos más importantes, además del timol, los naftoles, la fenolftaleína, el triclorofenol y el pentaclorofenol. Los compuestos naturales (pirocatequina, guayacol y sus derivados) no son tóxicos. Un derivado conocido de la pirocatequina es la adrenalina. El fenol se presenta en la Naturaleza en la madera y en las agujas de pino, en la orina de los herbívoros (fenolsulfato) y en el alquitrán de hulla. De los fenoles monohídricos se obtienen numerosas esencias (aromáticas) naturales, como por ejemplo: vainillina, timol, carvacrol, "zingiverón" (en jenjibre), aldehído salicílico. Entre los fenoles multivalentes sintéticos, el hexaclorofeno es particularmente tóxico.
Fuentes naturales
La elaboración de coque a partir del carbón de piedra proporciona importantes cantidades de fenol. El fenol se obtiene a partir de la destilación del alquitrán de hulla. Según RÖMPP (1983), con 1 tonelada de hulla se obtiene aproximadamente 0,25 kg de fenol. Actualmente, sin embargo, predomina la producción sintética por disociación del hidroperóxido de cumeno, obteniéndose acetona como producto secundario. En parte aún se recurre a la síntesis a partir del benceno, utilizando ácido bencenosulfónico o clorobenceno.
En los seres vivos están presentes con frecuencia formas mas complejas de fenoles, como aceites esenciales en el te o el tomillo, o como hormonas en los animales superiores y el hombre.
Biosíntesis
Los fenoles de las plantas son sintetizados por muchas vías distintas y por lo tanto también son un grupo heterogéneo desde el punto de vista metabólico, pero dos vías básicas están involucradas: la vía del ácido shikímico y la vía del ácido malónico.
La vía del ácido shikímico participa en la biosíntesis de la mayoría de los fenoles de las plantas superiores. Utiliza como sustratos la eritrosa-4-fosfato (de la vía de las pentosas fosfato) y el ácido fosfoenolpirúvico (proveniente de la glucólisis). Uno de los productos de esta vía es la fenilalanina, de la que se deriva la mayoría de los fenoles. La fenilalanina, un aminoácido esencial parte del metabolismo primario de las plantas y animales, entra al metabolismo secundario cuando la enzima fenilalanina amonio liasa (PAL) cataliza la eliminación de un amonio convirtiendo a la fenilalanina en ácido cinámico.
La vía del ácido malónico es una importante fuente de fenoles en bacterias y hongos, y en las plantas superiores existe aunque no es tan utilizada como en aquéllos. Su sustrato es el acetil-CoA. Junto con la vía del ácido shikímico participa en la biosíntesis de los flavonoides, la lignina y otros fenoles.
Usos y aplicaciones
El fenol es una sustancia con enorme valor industrial, directamente o en derivados, se usa como desinfectante, anestésicos tópicos y germicidas. Grandes cantidades de fenol se usan para la producción de formaldehido, resinas y plásticos.
La bakelita, un termoplástico que se produce industrialmente desde 1909 es un polímero del formaldehido cuya base principal es el fenol.
El fenol se utiliza para la preparación de resinas sintéticas, medicamentos, plaguicidas, colorantes sintéticos, sustancias aromáticas, aceites lubricantes, solventes entre muchos otros.
Efectos sobre la salud y el medio ambiente
Los fenoles son compuestos que se absorben rápidamente por la inhalación del vapor, en contacto con la piel y por ingestión, alcanzándose una concentración nociva en el ambiente por evaporación de la sustancia a 20º C.
Cuando la exposición a la sustancia es de corta duración, el vapor es corrosivo al contacto con los ojos, la piel y el tracto respiratorio, pudiendo causar graves quemaduras. Por inhalación provoca alteraciones en el sistema nervioso central, el corazón y el riñón, dando lugar a convulsiones, alteraciones cardíacas, fallos respiratorios, colapsos, estado de coma e incluso la muerte.
Respecto de su incidencia con el medio ambiente, es un sustancia nociva para los organismos acuáticos, provocándoles efectos adversos de distinta magnitud en función de la concentración a la que se encuentren expuestos. Esta sustancia está clasificada como Compuesto Orgánico Volátil (VOC) y puede contribuir potencialmente a la formación de ozono troposférico, dañino para los cultivos, la fauna y el hombre.
Emisiones
Surgen emisiones por combustión incompleta de la gasolina y del alquitrán de hulla, en el agua residual de coquerías y como metabolitos en la fotólisis del benceno y del clorobenzeno.
Dado que los fenoles sintéticos son más tóxicos que los fenoles naturales, es necesario disminuir urgentemente las emisiones de esta sustancia. En la manipulación del fenol debe evitarse esencialmente su contacto con la piel y su inhalación.
Agua
El fenol es más pesado que el agua y se hunde. Se disuelve lentamente y forma, incluso en dilución, soluciones tóxicas. En Alemania, el fenol se encuadra en el grupo de sustancias clasificadas como "Amenaza para el agua - Clase 2" debido a su considerable toxicidad en este medio.
Aire
Los vapores son más pesados que el aire y, expuestos al calor, forman mezclas explosivas. La oxidación del fenol en el aire se acelera por efecto de la luz o de impurezas que actúan como catalizadores.
Suelo
Debido a la degradación microbiana (aeróbica o anaeróbica) la acumulación de fenol en el suelo es escasa; el nivel de esta acumulación depende de la presencia de minerales arcillosos (gran afinidad con el óxido de aluminio).
Degradación, productos de la descomposición
La biodegradabilidad de los fenoles naturales es en general muy buena, de modo que casi no hay acumulación en plantas o animales. La degradación bacteriana del fenol continúa hasta la descomposición total en dióxido de carbono. En el suelo puede producirse su condensación a ácido húmico. Los fenoles sintéticos se degradan con menos facilidad, puesto que muchos de ellos son tóxicos para los microorganismos. Su toxicidad se incrementa con el número de átomos de cloro o de nitrógenos hayan sido incorporados a los fenoles. Por lo tanto, el pentaclorofenol es el más tóxico de los clorofenoles y el trinitrofenol (ácido pícrico) es el compuesto más tóxico de los nitrofenoles.
La descomposición en los cuerpos de agua superficiales se cumple en aproximadamente 7 días al 90% (aguas estancadas) y en el suelo alcanza la misma proporción en aproximadamente 1 día según la microflora y concentración (RIPPEN, 1989); la degradación total en las suspensiones de lodo requiere más de 2 días.
Los metabolitos de los fenoles pueden ser también extraordinariamente tóxicos: la combustión incompleta del 2,4,5-triclorofenol puede desembocar en la formación de TCDD (dioxina). Por regla general, la biodegradación produce ácido acético y CO2 pasando por la pirocatequina, o-chinona y ácidos dicarboxílicos (RIPPEN, 1989).
El fenol se elimina del organismo por vía urinaria, después de su oxidación o conjugación con ácido sulfúrico o glucónico.
Cadena alimentaria
Se produce poca acumulación en los alimentos. Los fumadores están más expuestos, porque el humo del cigarrillo contiene fenoles. La presencia de fenol en aguas subterráneas también contamina el agua potable, la que ya no se podrá consumir debido a su sabor desagradable.
Documentación
Requena, L. Vamos a Estudiar Química Orgánica. (2001). Ediciones
ENEVA
http://ces.iisc.ernet.in
http://fenolesfd.blogspot.com
http://medicina.usac.edu.gt/
http://www.prtr-es.es
http://www.sabelotodo.org
http://www.salonhogar.net/
http://es.wikipedia.org/